Esta es una practica en la que utilizamos el mechero con alcohol para realizarla utilizamos diferentes elementos como son el potasio, cloruro de sodio, etc... al ser introducidos en el fuego del mechero cambia de color con los elementos dependiendo de cual sea.
jueves, 7 de marzo de 2013
PRACTICA IV
En esta practica utilizamos tiritas con diferentes elementos paraa medir su nivel de HP, anotar sus
diferentes reacciones que estas provocan ya sea como cambio de color etc.
La practica fue muy buena y muy entretenida ya que nos enseña mucho sobre algunos elementos
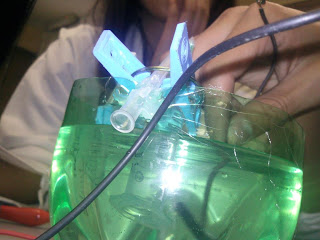
ACTIVIDAD EXPERIMENTAL #6 ELECTROLISIS DE UNA SOLUCION ACUOSA DE YODURO DE POTASIO
Problema
¿Las sales inorgánicas se pueden separar utilizando la electrólisis?
Objetivo
- Explicará la electrolisis de una sal aplicando el modelo de compuesto iónico.
· Destacará que en el ánodo se efectúa la oxidación y en el cátodo la reducción y se concluirá que la electrolisis es un proceso redox.
- Observar como la sal del yoduro de potasio es descompuesta en sus iones correspondientes por medio de la electrólisis.
MATERIAL PARA TRAER DE CASA
· 1 cuba hidroneumática ( base de 10cm recipiente de refresco 3L)
· 3 jeringas de 5mL
· 2 hisopos
· 2 pinzas para tender ropa
· Fuente de poder (eliminador de 12V o pila de 9 V)
· Pistola de silicón con barras de silicón
· 1 grafito extraído de las pilas secas de la marca rocket
· 50cm Cable de serie navideña
Sustancias
Solución de yoduro de potasio 0.1M.
Fenolftaleína.
Hidróxido de potasio
Almidón
Agua destilada
2 vasos de precipitados de 50 mL
1 gotero
1 espátula
Procedimiento
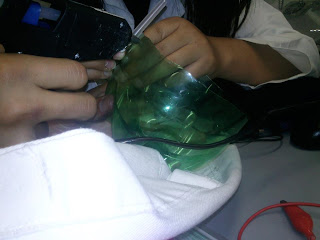
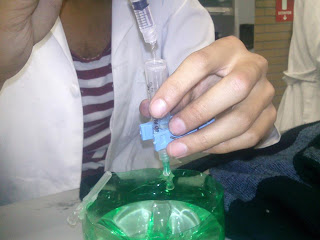
1. En el recipiente de plástico pegar por fuera las protecciones de las agujas con cinta adhesiva o silicón.
2. Agregar al recipiente 100 ml. de agua de la llave y disolver en ella 2 g. de KI. y agregar 6 gotas de fenolftaleína.
3. Cortar las agujas y sellar con silicón.
4. Los grafitos se sujetan con el cable y se sellan con silicón.
5. Con las pinzas, sujetar las jeringas de 5 ml. y llenarlas con la disolución de KI (para llenarlas utilizar la jeringa de 3 ml.).
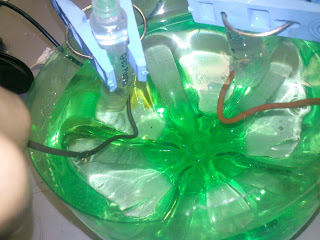
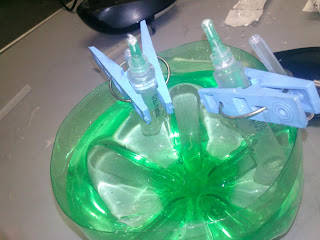
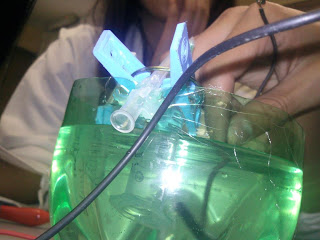
6. Se introducen las jeringas de 5 ml. En el recipiente y se sujetan las pinzas de las protecciones de las agujas.
7. Se conecta el eliminador a 9 o 12 v. o pila de 9 v.
8. En el ánodo se observará un color marrón debido a la presencia de I2 y en el cátodo un color rosa intenso.
ACTIVIDAD EXPERIMENTAL # 5 SOLUBILIDAD Y CONDUCTIVIDAD ELÉCTRICA DE LAS SALES
Problema:
¿En general se puede afirmar que las sales se disuelven y conducen la
corriente eléctrica mejor en el agua que en el alcohol?
Hipótesis
Objetivos:
§ Realizar una comparación de la capacidad de las
sales de disolverse en agua y en el alcohol
§ Observar y determinar en qué medio se conduce mejor
la electricidad las sales con agua o las sales con alcohol.
Marco Teórico.
Por su carácter
polar, el agua disuelve a un gran número de sustancias sólidas, líquidas o
gaseosas, orgánicas e inorgánicas. Es por ello que se le denomina el disolvente
universal. Por ejemplo, el NaCl cloruro de sodio es un
compuesto iónico muy soluble en agua.
La
elevada solubilidad de este compuesto radica en la atracción que los polos
parciales positivos y negativos de la molécula de agua ejercen sobre los iones de
Na+ y de Cl- de los cristales del NaCl. Específicamente
las cargas parciales positivas de los hidrógenos de la molécula de agua atraen
a la carga negativa del anión cloruro Cl-, mientras que la carga
parcial negativa del átomo de oxígeno ejerce la atracción sobre el catión sodio Na+. Estas
interacciones electrostáticas producen la ionización del cloruro de sodio, y
los iones Na+ y Cl- se dispersan en la disolución, para
ser consecuentemente hidratados
Compuestos iónicos
·
Son
sólidos con punto de fusión altos (por lo general, > 400ºC)
·
Muchos
son solubles en disolventes polares, como el agua..
·
La
mayoría es insoluble en disolventes no
polares, como el hexano C6H14.
·
Los compuestos fundidos conducen bien la
electricidad porque contienen partículas móviles con carga (iones)
·
Las
soluciones acuosas conducen bien la electricidad porque contienen partículas móviles con carga (iones).
|
Materiales
|
Sustancias
|
|
Una gradilla
|
Agua destilada
|
|
12 tubos de ensayo
|
Cloruro de Sodio ( NaCl )
|
|
Una balanza electrónica o
granataria
|
Yoduro de potasio ( KI )
|
|
Agitador de vidrio
|
Cloruro de Cobre II (CuCl2
)
|
|
Conductímetro ( pila de 9 V,
foco piloto, 2 caimanes pequeños)
|
Sulfato de Calcio (CaSO4)
|
|
Una cápsula de porcelana
|
Nitrato de potasio ( KNO3
)
|
|
Un microscopio estereoscópico
|
Nitrato de Amonio (NH4NO3)
|
|
Un vidrio de reloj
|
|
Procedimiento
1. Observar
las características de las sustancias utilizando el microscopio y registra tus
resultados en la tabla anexa.
2. Determinar
con un aparato de conductividad eléctrica (conductímetro) si las sales conducen
electricidad en estado sólido.
3. Numerar
los tubos de ensayo del 1 al 12
4. Pesar
0.4 g de cada una de las sustancias y agregarlas a los primeros 6 tubos como se
indica en la tabla, posteriormente adicionar 5mL de agua destilada a cada uno
de ellos, agita, y anota tus resultados.
5. Vierte
la disolución del tubo 1 obtenida en una capsula de porcelana, introduce los
electrodos del circuito eléctrico en la solución y determina si esta conduce
corriente eléctrica. Repite la operación con los demás tubos y registra tus
resultados.
6. Repite
nuevamente el procedimiento anterior utilizando los tubos del 7 al 12
utilizando 5 mL de alcohol en lugar de agua y nuevamente registra los
resultados en la tabla.
Suscribirse a:
Entradas (Atom)





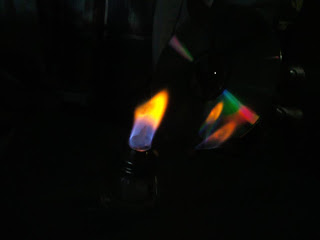













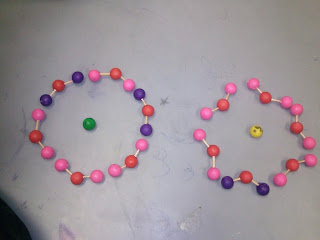





.jpg)



.jpg)